
不溶性微粒应用专题 | ALP_AN_200_CN_中国药典不溶性微粒标准的演进之路_v2.0
首次发布日期:2025-09-15(v1.0)
奥法美嘉微纳米应用工程中心 - 陈祎园

本文隶属于不溶性微粒应用专题,全文共 2445字,阅读大约需要 8 分钟
中国药典不溶性微粒标准的演进之路 — 对比2020版、2025版与USP,洞察国际接轨新趋势_v2.0
V2.0版本我们对文章内容进行了更新,以反映最新标准解读与表述优化。本次更新修订了部分数据说明与措辞,提升可读性与专业性。
2025年版本的中国药典在不溶性微粒检测领域迎来重要修订与补充,不仅对原有 <0903> 不溶性微粒检查法进行了多项更新和优化,还新增 <4206> 药包材不溶性微粒测定法和 <3903> 眼用注射剂不溶性微粒检测专章。本文将这些更新内容与美国药典(USP)这一国际主流药典进行比对,剖析中国药典在检测范围和质控理念等方面的调整逻辑,揭示其向国际标准逐步靠拢的趋势[1]。以下是2025 年版中国药典不溶性微粒检测的更新要点
表1.2025年中国药典不溶性微粒检测更新要点


美国药典(USP)、欧洲药典(EP)与日本药典(JP)在注射液不溶性微粒检测的核心要求高度一致:三者均以光阻法和显微计数法为基础检测手段,对≥10μm 和≥25μm 粒径微粒的限定标准统一,且在方法优先级(光阻法为主、显微法为辅)、系统适用性基本要求等保持同步,技术要求无本质差异。鉴于此,本文将重点对比中国药典(ChP)与 美国药典(USP)的具体差异;若需详细了解 USP、EP、JP 及 ChP 在检测流程、样品处理、专项标准等方面的细节异同,可参考李月、沙先谊撰写的《各国对注射液不溶性微粒的监管要求及在生物技术药物的应用思考》(《中国药事》2024 年第 38 卷第 1 期)[2]。
以下是2025年CP<0903>不溶性微粒检查法更新部分与美国药典USP的逐项对比:
表2.CP<0903>不溶性微粒检查法更新与USP对比

从上表中可以看出,从检查对象、用水标准、测试取样到仪器管理,CP2025年的改动整体趋势朝着USP的规则调整,既让检测过程和结果更可靠,也方便和国际标准接轨[3]。

中国药典对药包材的要求在不断收紧,且越来越向国际标准看齐。2025年版《中国药典》<4206> 药包材不溶性微粒测定法,以原国家药包材标准(YBB,如YBB00272004-2015等)为基础升级而来,构建了“1+4+58”体系,以9621通用要求为总纲,配套玻璃、橡胶、塑料、金属 4 类材质专项原则和 8项检测方法,覆盖范围从传统的玻璃、塑料扩展到金属等更多材质[4][5]。
国际标准中,USP/EP 无包材单独章节,仅提制剂整体微粒要求(如 USP788、EP2.9.19),国外采用较多的是ISO设的专用标准,如胶塞活塞类的ISO 8871-3,免洗免灭注射剂瓶的ISO 21882等[6][7]。
2025年版《中国药典》新增的4206 药包材不溶性微粒测定法,其规定十分细致,适用范围明确包含注射剂用橡胶密封件、塑料容器、预灌封注射器活塞及金属容器等关键组件,实现了对高风险包材的全面覆盖。检测时,光阻法要求振荡频率严格控制在 300 转/分 ±10 转/分,每次取样量不少于 5mL,还需弃去首次数据取后续 3 次的平均值,与不溶性微粒检查法0903要求一致。这些操作细节,既让药包材标准更严格,也便于和国际标准比对[8]。
以下是CP2025 <4206>、YBB00272004-2015、
ISO21882的对比:
表3. CP2025 <4206>、YBB00272004-2015、ISO21882对比


在2025年版《中国药典》实施前,我国药典虽对静脉注射剂的不溶性微粒检测有明确要求,但未针对眼用注射剂制定专门的检测标准,难以充分适配眼内组织对微粒污染的高敏感性需求。随着医药监管与国际接轨的推进,2025年版《中国药典》首次收载3903 生物制品眼内注射剂不溶性微粒检查法”填补了这一空白。该标准在技术规范上紧密对标国际先进要求,参照美国药典USP〈789〉眼用注射剂不溶性微粒检测专章和中国药典CP0903不溶性微粒检测专章的检测要求,吸收国际经验,通过建立更精准的专属标准,既强化了眼内注射剂的安全性控制,也实现了与国际主流药典在眼科制剂质量控制体系上的实质性接轨。
表4.CP<3903>眼用制剂不溶性微粒检查法与USP<789>对比
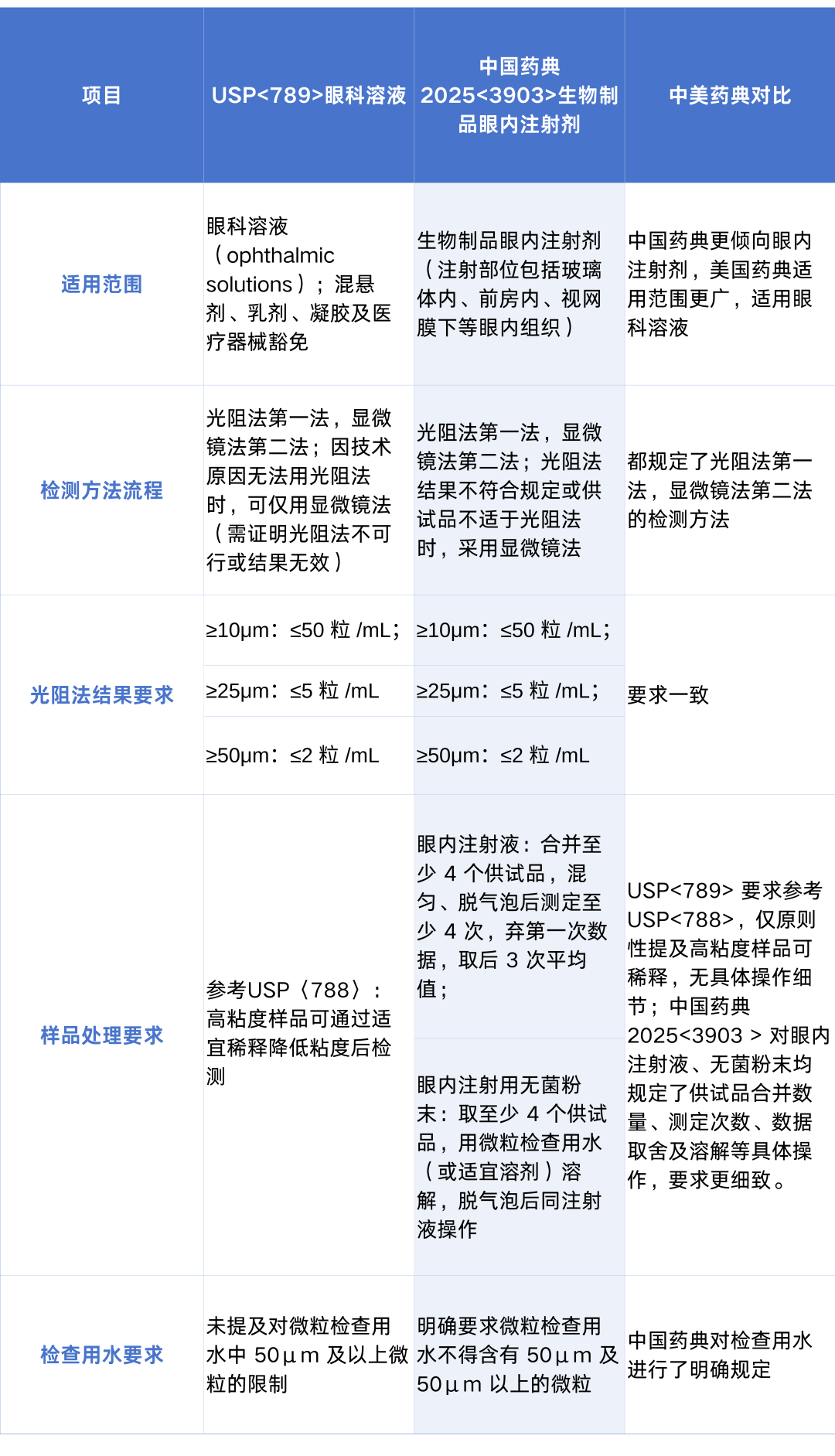
综上所述,2025年版《中国药典》在不溶性微粒检测方面的修订与新增条款,体现出明显的国际接轨趋势。一方面,通过对检测范围、取样方法、检查用水和仪器校准等环节的优化,中国药典逐步与国际主流药典保持一致,建立起更科学、合理且可比对的检测体系;另一方面,在药包材与眼用注射剂等高风险领域,中国药典不仅补齐了长期缺失的检测标准,还在部分指标上提出了严于国际的要求,凸显监管部门对药品安全性的高度重视。此次药典不溶性微粒检测更新,从范围和调整幅度上来看,都是一次具有显著规模与重要意义的关键更新,这对药企提出了更高标准,监管也会更严,因此药企需要更加重视不溶性微粒检测,主动适配新规,保障药品质量。可以预见,随着该标准的实施,中国药典将在全球药典体系中进一步提升权威性和兼容性,为保障公众用药安全与推动医药产业国际化发展提供坚实支撑。
此外,值得关注的是,近年来USP在 <1788> 通则中新增动态图像法作为不溶性微粒检测的第三法,该方法能通过颗粒形貌分析作为传统光阻法的正交方法,适用于生物药研发中蛋白聚集体的分析,适配眼用制剂等高风险领域的微粒监控,目前为推荐研究方法,未纳入<788>强制放行标准,现行产品放行仍以光阻法和显微计数法为主。结合 2025 版中国药典向国际标准靠拢的趋势,未来我国药典或可能借鉴这一技术方向,尤其在生物药、复杂制剂等领域探索其应用价值。药企可关注这一动态,以适配潜在的标准升级需求[9]。

参考文献
[1] 张军,宁保明,韦石凤,等.2025年版《中国药典》(四部)通用技术要求和指导原则增修订概况[J].中国药品标准,2025,26(1):34-43.
[2] 李月,沙先谊. 各国对注射液不溶性微粒的监管要求及在生物技术药物的应用思考[J].中国药事,2024,38(1):11-23.
[3] USP <788> Particulate Matter in Injections[S]. Rockville: United States Pharmacopeial Convention, 2020.
[4] 中华人民共和国药典(四部)<4206> 药包材不溶性微粒测定法[S]. 北京:中国医药科技出版社,2025.
[5] 包装材料不溶性微粒测定法:YBB 00272004-2015[S]. 国家药品监督管理局,2015.
[6] Sterile and ready-for-filling empty glass vials for injectable preparations: ISO 21882:2019[S]. Geneva: International Organization for Standardization, 2019.
[7] EP <2.9.19> Particulate Contamination: Subvisible Particles[S]. Strasbourg: Council of Europe, 2023.
[8] 王冬伟,李文丽,熊巍,等.《中华人民共和国药典》(2025年版)药包材不溶性微粒测定法研究[J].医药导报,2024,43(11):1740-1744.
[9] USP <1788> Methods for the Determination of Subvisible Particulate Matter[S]. Rockville: United States Pharmacopeial Convention, 2020.















